Vaccintechnologie op basis van zogenaamd ‘messenger-RNA’ (mRNA), soms ook wel boodschapper-RNA genoemd, is al enige tijd beschikbaar. Het gebruik ervan is echter pas onlangs geautoriseerd. Zowel patiënten als zorgverleners hebben dan ook veel vragen over hoe deze vaccins worden gemaakt en hoe ze werken.
Het is zeer waarschijnlijk dat mensen bekender zijn met DNA, dat al onze genen codeert, maar dat ze zich minder herinneren van dat wat tijdens biologielessen wordt verteld over mRNA. DNA wordt vaak gezien als de blauwdruk van een cel, en eiwitten zijn de materialen waaruit de structuur is opgebouwd. Als we deze gangbare analogie volgen, kan mRNA gezien worden als de instructies die voortkomen uit de interpretatie van de blauwdruk om alle structurele componenten te maken. Elk gen in DNA wordt in de celkern omgezet in een mRNA-boodschap. Vervolgens gaat de mRNA-boodschap naar het cytoplasma om daar door een ribosoom vertaald te worden naar een eiwit. Daarna wordt de mRNA-boodschap afgebroken.
DNA → mRNA → Eiwit
Er is jarenlang onderzoek verricht om te begrijpen hoe stabiel mRNA gemaakt kan worden en hoe dit kan worden ingekapseld in lipide nanodeeltjes voor aflevering in cellen. Hoewel het onderzoek op dit gebied zich blijft ontwikkelen, was deze kennis al beschikbaar bij het begin van de COVID-19-pandemie. Om een mRNA-vaccin voor COVID-19 te maken, was dus alleen nog de genetische sequentie van het doelantigen op de ziekteverwerkker nodig. Voor SARS-CoV-2 was dit het spike-gen. Kort nadat de genetische sequentie van SARS-CoV-2 in januari 2020 was vastgesteld, zijn bedrijven die gespecialiseerd zijn in mRNA-technologie, waaronder BioNTech en Moderna, begonnen met het maken van mRNA-vaccins voor COVID-19.
Het enige actieve ingrediënt in beide mRNA-vaccins is het mRNA zelf. Belangrijk om te weten is dat mRNA het cellulaire DNA niet kan veranderen, omdat het nooit in de celkern komt waar het DNA zich bevindt. De mRNA-vaccins bevatten ook lipiden die het mRNA beschermen en die helpen het in de cellen te krijgen, evenals zouten, suikers en buffers voor stabilisatie. De specifieke lipiden en stabilisatoren verschillen tussen de vaccins verschillen. Beide mRNA-vaccins zijn veilig bevonden, met gemiddeld minder dan vijf gevallen van anafylactische reacties per miljoen doses.
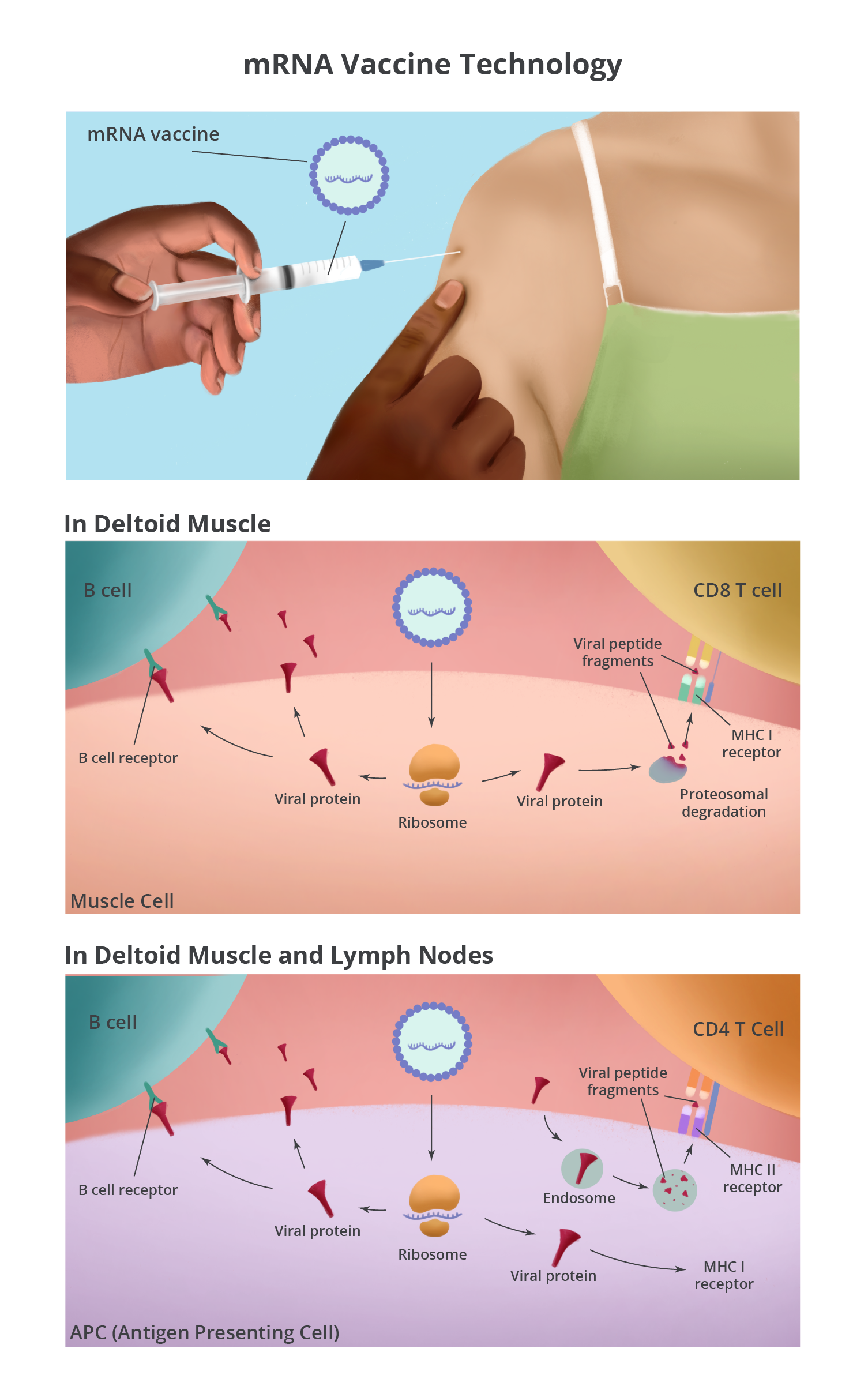
Beide mRNA-vaccins worden intramusculair toegediend via een injectie in de deltaspier van de arm. Door de hydrofobe aard van de lipide nanodeeltjes worden zij aangetrokken door de celmembranen. Zodra de lipiden met de cellen in de spier verbonden zijn, komt het mRNA vrij in het cytoplasma van de cel. In het cytoplasma doet het mRNA van het vaccin wat cellulair mRNA ook doet: het wordt door een ribosoom vertaald in eiwit – in dit geval het SARS-COV-2-spike-eiwit. Spiercellen rond de injectieplaats maken veel spike-eiwit aan, wat kan worden gedetecteerd door immuuncellen in het weefsel.
De injectieplaats is een prikwond en in het weefsel is een vloeistofbolus geïnjecteerd. Samen leiden deze twee zaken tot cellulaire stress die het immuunsysteem waarschuwt voor een mogelijk probleem. Bovendien wordt gedacht dat het mRNA zelf een ontstekingsreactie stimuleert die de immuunrespons op gang brengt. Deze ontstekings- en stressreactie trekt immuuncellen aan in de spier, wat kan leiden tot pijn, zwelling en roodheid van de injectieplaats op de arm.
Antigeen-presenterende cellen (APC’s) zijn een type immuuncel dat door de injectieplaats aangetrokken wordt. Het mRNA-vaccin kan APC’s binnendringen en spike-eiwit aanmaken (zoals het ook in de spiercellen doet) en B-cellen en CD8 T-cellen stimuleren. APC’s spelen nog een andere belangrijke rol bij het op gang brengen van de immuunrespons doordat zij op de injectieplaats extracellulaire eiwitten, dode cellen en resten oppikken. Ze breken de eiwitten af, waaronder het spike-eiwit, en presenteren peptidefragmenten aan CD4 T-cellen. Bovendien zijn APC’s niet statisch. Ze brengen antigenen van de injectieplaats naar de plaatselijke drainerende lymfeklieren, waar ze een grotere kans hebben B-cellen, CD4 T-cellen en CD8 T-cellen met receptoren die het spike-eiwit kunnen herkennen tegen te komen.
Wanneer antigenspecifieke lymfocyten worden geactiveerd, ondergaan zij een proces van proliferatie en differentiatie van naïeve cellen tot effectorcellen. De primaire functie van effector-B-cellen is het maken van antilichamen die in verschillende soorten bestaan en verschillende taken vervullen. Een belangrijke functie van de antilichamen die na vaccinatie worden aangemaakt, is neutralisatie (het virus binden en verhinderen dat het cellen infecteert). Effector CD4 T-cellen kunnen een breed scala aan functies vervullen, van het helpen van B-cellen bij het maken van de meest doeltreffende antilichamen tot het onderdrukken van de immuunrespons. Effector CD8 T-cellen staan vaak bekend als cytotoxische T-cellen omdat ze het lichaam doorzoeken en geïnfecteerde cellen elimineren. Soms kan al deze immuunactiviteit systemische symptomen veroorzaken zoals koorts, vermoeidheid en spierpijn. Dit is een normale reactie die reactogeniciteit genoemd wordt en vaker voorkomt na de tweede dosis van het mRNA-vaccin.
Het belangrijkste gevolg van vaccinatie is dat sommige effectorcellen blijven bestaan en zich het SARS-CoV-2-spike-eiwit blijven herinneren (deze cellen worden B-geheugencellen en T-geheugencellen genoemd). Als een gevaccineerd persoon met SARS-CoV-2 wordt besmet, binden de circulerende antilichamen het virus en zetten de B-geheugencellen en T-geheugencellen een snelle en krachtige reactie in gang om het virus uit de weg te ruimen. Met de mRNA-vaccins kan deze reactie symptomen voorkomen bij ongeveer 95% van de mensen, en ernstige COVID-19 en overlijden voorkomen bij 100%.
mRNA-vaccins zijn dan wel een nieuwe technologie, maar ze zijn in klinische studies aan dezelfde evaluatie onderworpen als andere vaccins eerder ondergaan hebben. De snellere autorisatie en distributie van een COVID-19-vaccin binnen een jaar was mogelijk om een paar redenen. Ten eerste heeft jarenlang onderzoek naar verkoudheidscoronavirussen en SARS- en MERS-virussen ertoe bijgedragen dat men begreep dat het spike-eiwit een belangrijk doelwit voor vaccinatie zou zijn. Ten tweede was de behoefte zo dringend dat veel bedrijven klinische studies begonnen op hetzelfde moment dat zij preklinische studies uitvoerden – een groot financieel risico. Tenslotte heeft het bepalen van de werkzaamheid van het vaccin door de wijde verspreiding van COVID-19 niet zo lang geduurd als het geval was voor andere vaccins die minder vaak voorkomende infecties tegengaan.
Nu wereldwijd al honderden miljoen mensen gevaccineerd zijn, laat het zich aanzien dat mRNA-vaccins tegen COVID-19 zowel veilig als doeltreffend zijn, en een belangrijk wapen zullen vormen bij het beëindigen van deze pandemie.
Het origineel van dit artikel werd geschreven door de medisch professionals op de redactie van DynaMed en is op 16 maart 2021 verschenen op EBSCO's Engelstalige Health Notes blog. We hebben het artikel zo zorgvuldig mogelijk voor u naar het Nederlands vertaald.